O que são ligações químicas?
Os átomos dos elementos químicos se ligam com outros átomos em busca da estabilidade, em processos chamados de ligações químicas. São elas que permitem que os elementos, categorizados na tabela periódica, se relacionem entre si e produzam milhões de substâncias. Quer entender um pouco mais sobre o assunto? Acompanhe o nosso post!
Introdução
Antes de partir para os estudos das ligações químicas, é preciso retomar alguns conceitos importantes.
Distribuição eletrônicas de elétrons
Os elétrons de um átomo orbitam em níveis de energia ou camadas eletrônicas, que são nomeadas de A a K. Cada uma dessas camadas comporta um número máximo de elétrons, conforme a figura abaixo:
| Nível | Camada | Nº máximo de elétrons |
| 1 | K | 2 |
| 2 | L | 8 |
| 3 | M | 18 |
| 4 | N | 32 |
| 5 | O | 32 |
| 6 | P | 18 |
| 7 | Q | 2 ou 8 |
Por sua vez, cada nível é dividido em sub níveis, em um uma classificação conhecida como diagrama de Pauling. Veja a figura:
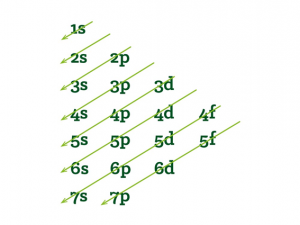
Cada um desses subníveis comporta o seguinte número de elétrons:
| Camada | s | p | d | f |
| Nº de elétrons | 2 | 6 | 10 | 14 |
Sabendo o número de elétrons do elemento químico, você deve escrever a sua distribuição eletrônica, sempre seguindo o diagrama de Pauling. Temos então:
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p
Assim você consegue descobrir o número de elétrons na última camada do elemento, fator importante para resolver um exercício sobre ligações químicas.
Gases nobres
Os gases nobres são considerados estáveis e raramente se ligam a outros elementos Apresentam 8 elétrons na última camada, com exceção do hélio, com 2 elétrons em um único nível.
Regra do octeto
Os átomos dos elementos químicos tendem a se ligar com outros elementos, doando, recebendo ou compartilhando elétrons. O objetivo é atingir o número de 8 elétrons na última camada, característica de estabilidade dos gases nobres. Há também elementos que buscam alcançar 2 elétrons na camada única e se assemelhar ao hélio, que é o caso do hidrogênio (H), por exemplo.
Tipos de ligações
Os átomos podem realizar diferentes relações entre si, perdendo, ganhando ou até mesmo compartilhando elétrons. Por isso, as ligações químicas são dividas em quatro tipos diferentes.
Ligação iônica
Também chamada de ligação eletrovalente, é estabelecida por íons de cargas opostas, em que um átomo fornece elétrons e outro os recebe. Formam-se íons positivos, chamados de cátions, e íons negativos, chamados de ânions, atraídos entre si por forças eletrostáticas.
As ligações iônicas acontecem entre metal + ametal e metal + hidrogênio. Isso ocorre graças às características contrárias desses elementos. Os metais apresentam baixa eletronegatividade e possuem, geralmente, 1, 2 ou 3 elétrons na última camada. Já os ametais, geralmente, trazem 5, 6 ou 7 elétrons na última camada e são caracterizados por uma alta eletronegatividade.
Veja o exemplo da substância NaCl, também conhecida como cloreto de sódio, segundo o diagrama de Linus Pauling:
11Na: 1s2 2s2 2p6 3s1
17Cl: 1s2 2s2 2p6 3s2 3p5
O Na (sódio) possui 1 e- (elétron) na última camada.Já o Cl (cloro), possui 7 e-. Com isso, o sódio doará seu elétron para o cloro, alcançando o octeto. O mesmo acontece com o cloro, que agora possui 8 elétrons na camada.
Como perdeu elétrons (negativos), o sódio fica com mais prótons (positivos) e torna-se o cátion. O contrário acontece com o cloro, que é chamado de ânion. Esses valores negativos e positivos devem estar representados na fórmula molecular da substância, com a ordem de cátions seguidos de ânions. Veja:
Na+Cl-
Veja outro exemplo com os elementos cálcio e cloro.
20Ca: 1s2 2s2 2p6 3s2 3p6 4s2
17Cl: 1s2 2s2 2p6 3s2 3p5
O cálcio perde os 2 elétrons da quarta camada, ficando com uma carga positiva de +2. Porém, o cloro só precisa de um, o que pede um segundo átomo de Cl para completar a ligação:
Cloreto de cálcio: CaCl2
Ligação covalente
As ligações covalentes são formadas por átomos com alta eletronegatividade e alta energia de ionização, ou seja, ambos querem ganhar elétrons, e não perdê-los. Por isso, eles compartilham ou emprestam os elétrons da camada de valência.
Essas ligações ocorrem nos seguintes casos:
Ametal + ametal
Ametal + hidrogênio
Hidrogênio + hidrogênio
Também são dividas em dois tipos, de acordo com a relação entre os átomos:
Ligação covalente normal ou simples
Os átomos envolvidos distribuem os seus elétrons para a última camada, permitindo que eles se unam com os elétrons de outro elemento e formem uma ligação de compartilhamento mútuo.
A relação só acontece graças à interpenetração dos orbitais atômicos, que é a união entre os elétrons dos átomos, criando uma zona de interseção que pertence a ambos os elementos ao mesmo tempo. Veja a representação da figura da molécula de H2:

H2 é a fórmula molecular da substância, que também pode ser escrita em sua fórmula estrutural H – H. A representação dos elementos com os elétrons que circundam a última camada é chamada de fórmula de Lewis.
As ligações covalentes simples podem compartilhar 2 ou 3 elétrons entre os átomos. Veja os exemplos:
O2
Vamos dividir as camadas do elemento de acordo com o diagrama de Linus Pauling:
6O: 1s2 2s2 2p4
Veja a fórmula de Lewis abaixo:

Observe que os átomos precisaram compartilhar dois elétrons, realizando uma dupla-ligação, também representada pela fórmula estrutural O=O.
N2
Segundo o diagrama de Pauling:
7N: 1s2 2s2 2p3
O elemento apresenta 5 elétrons na última camada; logo, a fórmula de Lewis da molécula será igual a:

Ambos os átomos de nitrogênio realizam uma tripla-ligação, representados pela fórmula estrutural N=N.
Um compartilhamento de um elétron é chamado de ligação s. Em um compartilhamento duplo, há uma ligação p e outra s. Já o compartilhamento de três elétrons possui duas ligações p e uma s. Lembre-se disso, já que os principais vestibulares podem trazer a representação das ligações de uma molécula dessa maneira.
Ligação covalente coordenada ou dativa
Essa ligação é propiciada por um átomo já estável que “empresta” um par de elétrons para que outro átomo também estabilize o octeto. É importante lembrar-se de que essa ligação só ocorre em pares.
Veja o exemplo com a molécula de ozônio (O3):
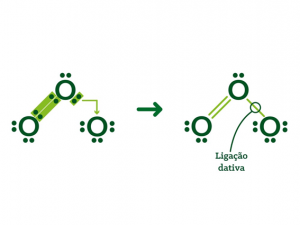
Observe que na molécula, dois átomos de oxigênio se estabilizaram com uma ligação covalente dupla. Assim foi possível “emprestar” um par de elétrons para que o outro átomo de oxigênio também alcançasse o octeto.
Ligação metálica
Como o próprio nome diz, é uma relação formada por um metal com outro. Ambos possuem baixo nível de ionização, perdendo elétrons com facilidade e formando cátions.
A ligação entre esses elementos é propiciada pela nuvem eletrônica ou mar de elétrons, uma força que une os átomos de metal e deixa os elétrons livres pela placa metálica, conforme a figura abaixo:
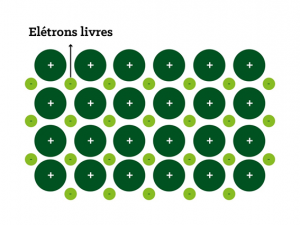
O fato de os elétrons estarem livres e se movimentarem pela placa explica a principal propriedade das ligações metálicas: a condutividade elétrica.
Ligas metálicas
São a mistura homogênea entre um metal com outro elemento metálico ou até mesmo com ametais. A liga metálica mais conhecida é o aço, formado de ferro e carbono: Fe + C. Outro exemplo é ouro 18k, formado por prata, ouro e cobre, que tem como propriedade o aumento da dureza do metal.
O aprendizado das ligações químicas é muito importante para a continuidade dos estudos da tabela periódica e das relações entre os elementos. Por isso, tire um bom tempo para estudar esse assunto e criar boas bases para o aprofundamento em outros temas próximos. Bons estudos!

